TERMOLOGIA
Se define como la energía
clórica o térmica puede ser transferida por diferentes mecanismos, existe en
varias formas de diferentes zonas. En
este caso nos enfocamos en el calor, que se encuentra a distintas temperaturas
mediante el proceso del cual la energía se puede transferir de un sistema a
otro como resultado de la diferencia de temperatura. Este flujo de energía
siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor
temperatura, ocurriendo la transferencia hace que ambos cuerpos se encuentren
en equilibrio termico Estos son la radiación, la conducion y la convección, de los procesos reales
que se encuentran presentes en mayor o menor grado. Que los cuerpos no tienen
calor, sino energía térmica y puede variar su
distinta temperatura.
ES
NECESARIO ENTENDER EL FUNCIONAMIENTO DE UN TERMÓMETRO
Un
termómetro es un instrumento que mide la temperatura de un sistema en forma
cuantitativa. Una forma fácil de hacerlo es encontrando una sustancia que tenga
una propiedad que cambie de manera regular con la temperatura.
La imagen del
termómetro de vidrio de mercurio contiene una ampolla fija con mercurio que le
permite expandirse dentro del capilar. Esta expansión fue calibrada sobre el
vidrio del termómetro. El mercurio es líquido dentro del rango de temperaturas
de -38,9° C a 356,7° C (la escala Celsius la vemos más adelante). Como un
líquido, el mercurio se expande cuando se calienta, esta expansión es lineal y puede ser calibrada con
exactitud
La
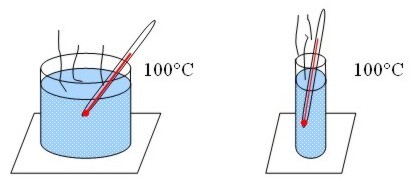
temperatura no depende del tamaño, ni del número ni del tipo. Por ejemplo, si
hacemos hervir agua en dos recipientes de diferente tamaño, la temperatura
alcanzada es la misma para los dos, 100° C, pero el que tiene más agua posee
mayor cantidad de calor.
El
calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor,
la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La temperatura no
es energía sino una medida de ella; sin embargo, el calor sí es energía. Medir
la concentración de energía y es aquella propiedad física que permite asegurar
si dos o más sistemas están o no en equilibrio térmico (cuando dos cuerpos están
a la misma temperatura), esto quiere decir que la temperatura es la magnitud
física que mide cuan caliente o cuan frío se encuentra un objeto.
En
las propiedades fisicoquímicas de
los materiales o las sustancias varían en función de la temperatura a la que se
encuentren, como por ejemplo su estado (sólido, líquido, gaseoso, plasma),
su volumen,
la solubilidad,
la presión de vapor,
su color o la conductividad eléctrica
En
el caso de un sólido, los movimientos en cuestión resultan ser las vibraciones de
las partículas en sus sitios dentro del sólido.
En
el caso de un gas
ideal monoatómico se
trata de los movimientos tras nacionales de sus partículas (para los gases
multiatómico los movimientos rotacional y vibraciones también deben tomarse en cuenta).
CALOR
El calor
en una reacción química o un cambio físico en la transferencia de energía entre
diferentes cuerpos o diferentes zonas que puede encontrarse a distintas
temperaturas
(Terrestres), y del consumo de oxígen
El calor se puede
transferir mediante convección, radiación o conducción.
Aunque estos tres
procesos pueden ocurrir al mismo tiempo, puede suceder que uno de los
mecanismos predomine sobre los otros dos. Por ejemplo, el calor se
trasmite a través de la pared de una casa fundamentalmente por conducción, el
agua de una cacerola situada sobre un quemador de gas se calienta en gran
medida por convección.
El
calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor,
la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La
temperatura no es energía sino una medida de ella; sin embargo, el calor sí es
energía.
Cambios
de estado:
En la
naturaleza existen tres estados usuales de la materia: sólido, líquido y
gaseoso. Al aplicarle calor a una sustancia, esta puede cambiar de un estado a
otro. A estos procesos se les conoce como
Los
posibles cambios de estado son:
-de
estado solidó a liquido, llamado fusión.
-de
estado liquido a solidó, llamado solidificación.
-de
estado liquido a gaseoso, llamado vaporización
-de
estado gaseoso a liquido, llamado condensación
-de
estado solidó a gaseoso, llamado sublimación progresiva.
-de
estado gaseoso a sólido, llamado sublimación regresiva
ESCALA TERMOMÉTRICA Y DILATACIÓN
ESCALAS TERMOMÉTRICAS
Para medir la temperatura existe un instrumento llamado
termómetro. Este instrumento está formado por un capilar muy fino en el
interior de un tubo de vidrio, ambos extremos están cerrados y en uno de ellos
se estrecha y el capilar tiene un bulbo con mercurio, el cual se dilata al más
mínimo cambio de temperatura.
Existen tres escalas termométricas conocidas
y estas son:
- ESCALA CELSIUS O CENTÍGRADA: Es la más usada, toma como
referencia el punto de fusión del agua para indicar la temperatura mínima,
es decir 0 ºC, y considera el punto de ebullición del agua para indicar la
temperatura más alta, o sea 100 ºC. Es una escala que considera valores
negativos para la temperatura, siendo el valor más bajo de -273 ºC.
- ESCALA FAHRENHEIT O
ANGLOSAJONA: Es
una escala que tiene 180º de diferencia entre el valor mínima y el máximo
del termómetro. También relaciona los puntos de fusión y ebullición del agua
para indicar los valores de temperatura. El valor mínimo es a los 32 ºF y
el máximo a los 212 ºF. Al igual que la escala Celsius, tiene valores
negativos de temperatura.
- ESCALA KELVIN O ABSOLUTA: Es una escala que no tiene valores negativos. El punto de fusión del agua en esta escala es a los 273 ºK y el punto de ebullición es a los 373 ºK y la mínima temperatura es 0º K que para la escala Centígrada resulta ser a los -273 ºK.
a) entre las escalas Celsius
y Kelvin:
ºK = ºC + 273 ºC = ºK - 273
b) entre las escalas Celsius
y Fahrenheit:
ºC = 5
(ºF - 32) 9
ECUACIONES QUE RELACIONAN LAS DIFERENTES ESCALAS
Lo particular de
esta ecuación es que se puede transformar de Celsius a Fahrenheit y vis y
versa.
Es necesario entender el concepto de equilibrio térmico. Si
dos partes de un sistema entran en contacto térmico es probable que ocurran
cambios en las propiedades de ambas. Estos cambios se deben a la transferencia
de calor entre las partes. Para que un sistema esté en equilibrio térmico debe
llegar al punto en que ya no hay intercambio neto de calor entre sus partes,
además ninguna de las propiedades que dependen de la temperatura debe variar.
CANTIDAD DE CALOR
Se
define como la energía cedida o absorbida por un cuerpo de masa cuando su
temperatura varía en un número determinado de grados.
Esta
relacionado directamente con la naturaleza de la sustancia que compone el
cuerpo. Se caracteriza por una magnitud por una magnitud denominada Calor
Específico de la sustancia
El carácter energético del
calor lleva consigo la posibilidad de transformarlo en trabajo mecánico. Sin
embargo, la naturaleza impone ciertas limitaciones a este tipo de conversión,
lo cual hace que sólo una fracción del calor disponible sea aprovechable en
forma de trabajo útil. (Ver Transferencia de calor)
Las
ideas acerca de la naturaleza del calor han variado menospreciablemente en los dos
últimos siglos
representa la cantidad de energía que
un cuerpo transfiere a otro como consecuencia de una diferencia de temperatura entre
ambos. El tipo de energía que se pone en juego en los fenómenos caloríficos se
denomina energía térmica. (Ver: Cantidad)
El calor no sólo era capaz de aumentar la temperatura o modificar
el estado físico de los cuerpos, sino que además podía moverlos y realizar un
trabajo.
Las
máquinas de vapor que tan espectacular desarrollo tuvieron a finales del siglo
XVIII y comienzos del XIX eran buena muestra de ello. Desde entonces las
nociones de calor y energía quedaron unidas y el progreso de la física permitió
encontrar una explicación detallada.






No hay comentarios:
Publicar un comentario