domingo, 29 de noviembre de 2015
jueves, 26 de noviembre de 2015
TRABAJO DE INVESTIGACION
INTRODUCCIÓN
En estos temas nos darán a conocer la definición y el proceso en
como se relacionan en su función de
acuerdo a una multitud que dan lugar a unidades de medición de la temperatura,
es necesario entender el concepto de los cambios que se deben a la transferencia
de calor entre las partes.
Para que un sistema esté en equilibrio térmico debe
llegar al punto en que ya no hay intercambio de calor entre sus partes, además
ninguna de las propiedades que dependen de la temperatura debe variar, esta y
mas información de mecanismos de diferentes cuerpos que nos dará mas
conceptos sobre la temperatura.
· Termología
· Temperatura
· Calor
· Escalas termométricas y
dilatación
· Cantidad de calo
TERMOLOGIA
Se define como la energía calórica o
térmica puede ser transferida por diferentes mecanismos, existe en varias formas de diferentes zonas. En este caso nos
enfocamos en el calor, que se encuentra a distintas temperaturas mediante el
proceso del cual la energía se puede transferir de un sistema a otro como
resultado de la diferencia de temperatura. Este flujo de energía siempre ocurre
desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo
la transferencia hace que ambos cuerpos se encuentren en equilibrio térmico Estos son la radiación,
la conducción y la convección,
de los procesos reales que se encuentran presentes en mayor o menor grado. Que
los cuerpos no tienen calor, sino energía térmica y puede variar su distinta
temperatura.
(Ejemplo: una bebida fría dejada en
una habitación se entibia).
CONDUCCIÓN TÉRMICA
La conducción es una transferencia de calor entre los cuerpos sólidos. Si una persona sostiene uno de los extremos de una barra metálica, y pone en contacto el otro extremo con la llama de una vela, de forma que aumente su temperatura, el calor se trasmitirá hasta el extremo más frío por conducción.
Los átomos o moléculas del extremo calentado por la llama, adquieren una mayor energía de agitación, la cual se trasmite de un átomo a otro, sin que estas partículas sufran ningún cambio de posición, aumentando entonces, la temperatura de esta región. Este proceso continúa a lo largo de la barra y después de cierto tiempo, la persona que sostiene el otro extremo percibirá una elevación de temperatura en ese lugar.
Existen conductores térmicos, como los metales, que son buenos conductores del calor, mientras que existen sustancias, como plumavit, corcho, aire, madera, hielo, lana, papel, etc., que son malos conductores térmicos (aislantes).
CONVECCIÓN TÉRMICA
Si existe una diferencia de temperatura en el interior de un líquido o un gas, es casi seguro que se producirá un movimiento del fluido. Este movimiento transfiere calor de una parte del fluido a otra por un proceso llamado convección.
Cuando un recipiente con agua se calienta, la capa de agua que está en el fondo recibe mayor calor (por el calor que se ha trasmitido por conducción a través de la cacerola); esto provoca que el volumen aumente y, por lo tanto, disminuya su densidad, provocando que esta capa de agua caliente se desplace hacia la parte superior del recipiente y parte del agua más fría baje hacia el fondo.
TEMPERATURA
En física, se define
como una energía interna de un sistema
termodinámico, está relacionada directamente con la parte de la energía interna
conocida como «energía cinética», que es la energía asociada a los movimientos
de las partículas del sistema, sea en un sentido trasnacional, rotacional, o en
forma de vibraciones. El desarrollo de
técnicas para la medición de la temperatura ha pasado por un largo proceso
histórico, ya que es necesario darle un valor numérico a una idea intuitiva
como es lo frío o lo caliente mediante un termómetro
.
A
medida que sea mayor la energía cinética de un sistema, se observa que éste se
encuentra más «caliente»; es decir, que su temperatura es mayor, Así mismo es
uno de los factores que influyen en la velocidad a la que tienen lugar las reacciones químicas.
El calor es lo que
hace que la temperatura aumente o disminuya. Si añadimos calor, la temperatura
aumenta. Si quitamos calor, la temperatura disminuye.
La temperatura no
es energía sino una medida de ella; sin embargo, el calor sí es energía. Medir
la concentración de energía y es aquella propiedad física que permite asegurar
si dos o más sistemas están o no en equilibrio térmico (cuando dos cuerpos
están a la misma temperatura), esto quiere decir que la temperatura es la
magnitud física que mide cuan caliente o cuan frío se encuentra un objeto.
En
las propiedades fisicoquímicas de
los materiales o las sustancias varían en función de la temperatura a la que se
encuentren, como por ejemplo su estado (sólido, líquido, gaseoso, plasma), su volumen,
la solubilidad, la presión de vapor, su
color o la conductividad eléctrica
En
el caso de un sólido, los movimientos en cuestión resultan ser las vibraciones de
las partículas en sus sitios dentro del sólido.
En
el caso de un gas ideal monoatómico se
trata de los movimientos trasnacionales de sus partículas (para los gases
multiatómico los movimientos rotacional y vibraciones también deben tomarse en cuenta).
CALOR
El calor en
una reacción química o un cambio físico en la transferencia de energía entre
diferentes cuerpos o diferentes zonas que puede encontrarse a distintas
temperaturas
Este flujo siempre ocurre
desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura,
ocurriendo la transferencia de calor hasta que ambos cuerpos se encuentren en
equilibrio térmico, producen a partir de la producción de dióxido de carbono y
de nitrógeno (urea en organismos terrestres), y del consumo de oxígeno.
(Terrestres), y del consumo de oxígen
El calor es la cantidad de energía cinética, es una expresión del movimiento de las moléculas que componen un cuerpo. Cuando el calor entra en un cuerpo se produce calentamiento y cuando sale, enfriamiento. Incluso los objetos más fríos poseen algo de calor porque sus átomos se están moviendo.
El tipo de energía que se pone en juego en los fenómenos caloríficos se denomina energía térmica. El carácter energético del calor lleva consigo la posibilidad de transformarlo en trabajo mecánico. Las máquinas de vapor que tan espectacular desarrollo tuvieron a finales del siglo XVIII y comienzos del XIX eran buena muestra de ello. Desde entonces las nociones de calor y energía quedaron unidas y el progreso de la física permitió, a mediados del siglo pasado, encontrar una explicación detallada para la naturaleza de esa nueva forma de energía, que se pone de manifiesto en los fenómenos caloríficos.
El
calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor,
la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La
temperatura no es energía sino una medida de ella; sin embargo, el calor sí es
energía.
Cambios
de estado:
En la
naturaleza existen tres estados usuales de la materia: sólido, líquido y
gaseoso. Al aplicarle calor a una sustancia, esta puede cambiar de un estado a
otro. A estos procesos se les conoce como
Los
posibles cambios de estado son:
-de
estado solidó a liquido, llamado fusión.
-de
estado liquido a solidó, llamado solidificación.
-de
estado liquido a gaseoso, llamado vaporización
-de
estado gaseoso a liquido, llamado condensación
-de
estado solidó a gaseoso, llamado sublimación progresiva.
-de
estado gaseoso a sólido, llamado sublimación regresiva.
ESCALA TERMOMÉTRICA Y
ESCALAS TERMOMÉTRICAS
Para
medir la temperatura existe un instrumento llamado termómetro. Este instrumento
está formado por un capilar muy fino en el interior de un tubo de vidrio, ambos
extremos están cerrados y en uno de ellos se estrecha y el capilar tiene un
bulbo con mercurio, el cual se dilata al más mínimo cambio de temperatura.
Existen tres escalas termométricas conocidas y estas son:
- ESCALA CELSIUS O
CENTÍGRADA: Es la más
usada, toma como referencia el punto de fusión del agua para indicar la
temperatura mínima, es decir 0 ºC, y considera el punto de ebullición del
agua para indicar la temperatura más alta, o sea 100 ºC. Es una escala que
considera valores negativos para la temperatura, siendo el valor más bajo
de -273 ºC.
- ESCALA FAHRENHEIT O
ANGLOSAJONA: Es una
escala que tiene 180º de diferencia entre el valor mínima y el máximo del
termómetro. También relaciona los puntos de fusión y ebullición del agua
para indicar los valores de temperatura. El valor mínimo es a los 32 ºF y
el máximo a los 212 ºF. Al igual que la escala Celsius, tiene valores
negativos de temperatura.
- ESCALA KELVIN O
ABSOLUTA: Es una escala que
no tiene valores negativos. El punto de fusión del agua en esta escala es
a los 273 ºK y el punto de ebullición es a los 373 ºK y la mínima
temperatura es 0º K que para la escala Centígrada resulta ser a los -273
ºK.
ECUACIONES QUE RELACIONAN LAS DIFERENTES ESCALAS.
a) entre las escalas Celsius y Kelvin:
ºK = ºC + 273 ºC = ºK - 273
b) entre las escalas Celsius y Fahrenheit:
ºC = 5
(ºF - 32) 9
Lo particular de esta ecuación
es que se puede transformar de Celsius a Fahrenheit y vis y versa.
Es necesario entender el concepto de Equilibrio termico. Si dos partes de un
sistema entran en contacto térmico es probable que ocurran cambios en las
propiedades de ambas. Estos cambios se deben a la transferencia de calor entre
las partes. Para que un sistema esté en equilibrio térmico debe llegar al punto
en que ya no hay intercambio neto de calor entre sus partes, además ninguna de
las propiedades que dependen de la temperatura debe variar.
CANTIDAD DE CALOR
Se
define como la energía cedida o absorbida por un cuerpo de masa cuando su
temperatura varía en un número determinado de grados.
Esta
relacionado directamente con la naturaleza de la sustancia que compone el
cuerpo. Se caracteriza por una magnitud por una magnitud denominada Calor
Específico de la sustancia
El carácter energético del calor lleva
consigo la posibilidad de transformarlo en trabajo mecánico. Sin embargo, la
naturaleza impone ciertas limitaciones a este tipo de conversión, lo cual hace
que sólo una fracción del calor disponible sea aprovechable en forma de trabajo
útil. (Ver transferencia de calor)
Las
ideas acerca de la naturaleza del calor han variado apreciable mente en los dos últimos
siglos
representa la cantidad de energía que
un cuerpo transfiere a otro como consecuencia de una diferencia de temperatura entre
ambos. El tipo de energía que se pone en juego en los fenómenos caloríficos se
denomina energía térmica. (Ver: Cantidad)
El calor no sólo era capaz de aumentar la temperatura o modificar
el estado físico de los cuerpos, sino que además podía moverlos y realizar un
trabajo.
Las
máquinas de vapor que tan espectacular desarrollo tuvieron a finales del siglo
XVIII y comienzos del XIX eran buena muestra de ello. Desde entonces las
nociones de calor y energía quedaron unidas y el progreso de la física permitió
encontrar una explicación detallada. Características: En la simulación se puede modificar la masa de hielo
introducida, así como el valor de la de agua añadida, Podemos realizar el
cálculo de modo sencillo. Hay una explicación teórica previa.
Características: En la simulación se puede modificar la masa de hielo
introducida, así como el valor de la de agua añadida, Podemos realizar el
cálculo de modo sencillo. Hay una explicación teórica previa.BIENVENIDOS
Bienvenido a Física Básica II.
- Conceptos básicos: se ofrece un pequeño resumen sobre los conceptos teóricos más importantes del tema, presentando también un enlace (¿sabías que...?) a explicaciones de curiosidades o fenómenos físicos relacionados.
- Cuestionarios: son cuestionarios teóricos de opción múltiple auto evaluativos sobre los conceptos tratados anteriormente.
- Problemas resueltos: se plantean problemas para que el visitante de la página intente primero su resolución, ya que el desarrollo de la misma no aparece hasta que se elige la opción correspondiente.
En el menú de la izquierda aparecen los temas de la Física que serán desarrollados en esta página web. En cada uno de ellos puedes encontrar los siguientes apartados
miércoles, 25 de noviembre de 2015
INVESTIGACIÓN DE FÍSICA ACERCA DE DIFERENTES TIPOS DE TEMPERATURAS
TERMOLOGIA
Se define como la energía
clórica o térmica puede ser transferida por diferentes mecanismos, existe en
varias formas de diferentes zonas. En
este caso nos enfocamos en el calor, que se encuentra a distintas temperaturas
mediante el proceso del cual la energía se puede transferir de un sistema a
otro como resultado de la diferencia de temperatura. Este flujo de energía
siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor
temperatura, ocurriendo la transferencia hace que ambos cuerpos se encuentren
en equilibrio termico Estos son la radiación, la conducion y la convección, de los procesos reales
que se encuentran presentes en mayor o menor grado. Que los cuerpos no tienen
calor, sino energía térmica y puede variar su
distinta temperatura.
ES
NECESARIO ENTENDER EL FUNCIONAMIENTO DE UN TERMÓMETRO
Un
termómetro es un instrumento que mide la temperatura de un sistema en forma
cuantitativa. Una forma fácil de hacerlo es encontrando una sustancia que tenga
una propiedad que cambie de manera regular con la temperatura.
La imagen del
termómetro de vidrio de mercurio contiene una ampolla fija con mercurio que le
permite expandirse dentro del capilar. Esta expansión fue calibrada sobre el
vidrio del termómetro. El mercurio es líquido dentro del rango de temperaturas
de -38,9° C a 356,7° C (la escala Celsius la vemos más adelante). Como un
líquido, el mercurio se expande cuando se calienta, esta expansión es lineal y puede ser calibrada con
exactitud
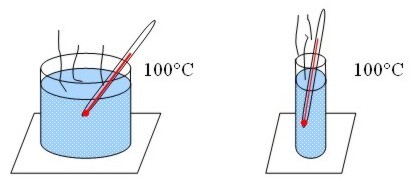
La
temperatura no depende del tamaño, ni del número ni del tipo. Por ejemplo, si
hacemos hervir agua en dos recipientes de diferente tamaño, la temperatura
alcanzada es la misma para los dos, 100° C, pero el que tiene más agua posee
mayor cantidad de calor.
El
calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor,
la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La temperatura no
es energía sino una medida de ella; sin embargo, el calor sí es energía. Medir
la concentración de energía y es aquella propiedad física que permite asegurar
si dos o más sistemas están o no en equilibrio térmico (cuando dos cuerpos están
a la misma temperatura), esto quiere decir que la temperatura es la magnitud
física que mide cuan caliente o cuan frío se encuentra un objeto.
En
las propiedades fisicoquímicas de
los materiales o las sustancias varían en función de la temperatura a la que se
encuentren, como por ejemplo su estado (sólido, líquido, gaseoso, plasma),
su volumen,
la solubilidad,
la presión de vapor,
su color o la conductividad eléctrica
En
el caso de un sólido, los movimientos en cuestión resultan ser las vibraciones de
las partículas en sus sitios dentro del sólido.
En
el caso de un gas
ideal monoatómico se
trata de los movimientos tras nacionales de sus partículas (para los gases
multiatómico los movimientos rotacional y vibraciones también deben tomarse en cuenta).
CALOR
El calor
en una reacción química o un cambio físico en la transferencia de energía entre
diferentes cuerpos o diferentes zonas que puede encontrarse a distintas
temperaturas
(Terrestres), y del consumo de oxígen
El calor se puede
transferir mediante convección, radiación o conducción.
Aunque estos tres
procesos pueden ocurrir al mismo tiempo, puede suceder que uno de los
mecanismos predomine sobre los otros dos. Por ejemplo, el calor se
trasmite a través de la pared de una casa fundamentalmente por conducción, el
agua de una cacerola situada sobre un quemador de gas se calienta en gran
medida por convección.
El
calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor,
la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La
temperatura no es energía sino una medida de ella; sin embargo, el calor sí es
energía.
Cambios
de estado:
En la
naturaleza existen tres estados usuales de la materia: sólido, líquido y
gaseoso. Al aplicarle calor a una sustancia, esta puede cambiar de un estado a
otro. A estos procesos se les conoce como
Los
posibles cambios de estado son:
-de
estado solidó a liquido, llamado fusión.
-de
estado liquido a solidó, llamado solidificación.
-de
estado liquido a gaseoso, llamado vaporización
-de
estado gaseoso a liquido, llamado condensación
-de
estado solidó a gaseoso, llamado sublimación progresiva.
-de
estado gaseoso a sólido, llamado sublimación regresiva
ESCALA TERMOMÉTRICA Y DILATACIÓN
ESCALAS TERMOMÉTRICAS
Para medir la temperatura existe un instrumento llamado
termómetro. Este instrumento está formado por un capilar muy fino en el
interior de un tubo de vidrio, ambos extremos están cerrados y en uno de ellos
se estrecha y el capilar tiene un bulbo con mercurio, el cual se dilata al más
mínimo cambio de temperatura.
Existen tres escalas termométricas conocidas
y estas son:
- ESCALA CELSIUS O CENTÍGRADA: Es la más usada, toma como
referencia el punto de fusión del agua para indicar la temperatura mínima,
es decir 0 ºC, y considera el punto de ebullición del agua para indicar la
temperatura más alta, o sea 100 ºC. Es una escala que considera valores
negativos para la temperatura, siendo el valor más bajo de -273 ºC.
- ESCALA FAHRENHEIT O
ANGLOSAJONA: Es
una escala que tiene 180º de diferencia entre el valor mínima y el máximo
del termómetro. También relaciona los puntos de fusión y ebullición del agua
para indicar los valores de temperatura. El valor mínimo es a los 32 ºF y
el máximo a los 212 ºF. Al igual que la escala Celsius, tiene valores
negativos de temperatura.
- ESCALA KELVIN O ABSOLUTA: Es una escala que no tiene valores negativos. El punto de fusión del agua en esta escala es a los 273 ºK y el punto de ebullición es a los 373 ºK y la mínima temperatura es 0º K que para la escala Centígrada resulta ser a los -273 ºK.
a) entre las escalas Celsius
y Kelvin:
ºK = ºC + 273 ºC = ºK - 273
b) entre las escalas Celsius
y Fahrenheit:
ºC = 5
(ºF - 32) 9
ECUACIONES QUE RELACIONAN LAS DIFERENTES ESCALAS
Lo particular de
esta ecuación es que se puede transformar de Celsius a Fahrenheit y vis y
versa.
Es necesario entender el concepto de equilibrio térmico. Si
dos partes de un sistema entran en contacto térmico es probable que ocurran
cambios en las propiedades de ambas. Estos cambios se deben a la transferencia
de calor entre las partes. Para que un sistema esté en equilibrio térmico debe
llegar al punto en que ya no hay intercambio neto de calor entre sus partes,
además ninguna de las propiedades que dependen de la temperatura debe variar.
CANTIDAD DE CALOR
Se
define como la energía cedida o absorbida por un cuerpo de masa cuando su
temperatura varía en un número determinado de grados.
Esta
relacionado directamente con la naturaleza de la sustancia que compone el
cuerpo. Se caracteriza por una magnitud por una magnitud denominada Calor
Específico de la sustancia
El carácter energético del
calor lleva consigo la posibilidad de transformarlo en trabajo mecánico. Sin
embargo, la naturaleza impone ciertas limitaciones a este tipo de conversión,
lo cual hace que sólo una fracción del calor disponible sea aprovechable en
forma de trabajo útil. (Ver Transferencia de calor)
Las
ideas acerca de la naturaleza del calor han variado menospreciablemente en los dos
últimos siglos
representa la cantidad de energía que
un cuerpo transfiere a otro como consecuencia de una diferencia de temperatura entre
ambos. El tipo de energía que se pone en juego en los fenómenos caloríficos se
denomina energía térmica. (Ver: Cantidad)
El calor no sólo era capaz de aumentar la temperatura o modificar
el estado físico de los cuerpos, sino que además podía moverlos y realizar un
trabajo.
Las
máquinas de vapor que tan espectacular desarrollo tuvieron a finales del siglo
XVIII y comienzos del XIX eran buena muestra de ello. Desde entonces las
nociones de calor y energía quedaron unidas y el progreso de la física permitió
encontrar una explicación detallada.
Suscribirse a:
Comentarios (Atom)